Skandium, jonka alkuainetunnus on Sc ja järjestysluku 21, liukenee helposti veteen, voi reagoida kuuman veden kanssa ja tummuu helposti ilmassa. Sen päävalenssi on +3. Sitä sekoitetaan usein gadoliniumin, erbiumin ja muiden alkuaineiden kanssa, jolloin saanto on alhainen ja sen pitoisuus kuoressa on noin 0,0005 %. Skandiumia käytetään usein erikoislasin ja kevyiden korkean lämpötilan seosten valmistukseen.
Tällä hetkellä maailman todistetut skandiumvarannot ovat vain 2 miljoonaa tonnia, josta 90–95 % on bauksiitti-, fosforiitti- ja rautatitaanimalmeja ja pieni osa uraani-, torium-, volframi- ja harvinaisten maametallien malmeja, jotka sijaitsevat pääasiassa Venäjällä, Kiinassa, Tadžikistanissa, Madagaskarilla, Norjassa ja muissa maissa. Kiina on erittäin rikas skandiumvaroiltaan, ja sillä on valtavat skandiumiin liittyvät mineraalivarannot. Puutteellisten tilastojen mukaan Kiinan skandiumvarannot ovat noin 600 000 tonnia, jotka sijaitsevat bauksiitti- ja fosforiittiesiintymissä, porfyyri- ja kvartsijuonivolframiesiintymissä Etelä-Kiinassa, harvinaisten maametallien esiintymissä Etelä-Kiinassa, Bayan Obon harvinaisten maametallien rautamalmiesiintymässä Sisä-Mongoliassa ja Panzhihuan vanadiini-titaanimagnetiittiesiintymässä Sichuanissa.
Skandiumin niukkuuden vuoksi myös skandiumin hinta on erittäin korkea, ja huipussaan skandiumin hinta oli kymmenkertainen kullan hintaan verrattuna. Vaikka skandiumin hinta on laskenut, se on edelleen neljä kertaa kullan hinta!
Historian löytäminen
Vuonna 1869 Mendelejev huomasi kalsiumin (40) ja titaanin (48) välisen atomimassaeron ja ennusti, että tässä oli myös löytämätön väliatomimassainen alkuaine. Hän ennusti, että sen oksidi on X ₂ O Å. Skandiumin löysi vuonna 1879 Lars Frederik Nilson Uppsalan yliopistosta Ruotsista. Hän louhi sitä mustasta harvinaisesta kultakaivoksesta, monimutkaisesta malmista, joka sisältää kahdeksaa erilaista metallioksidia. Hän on louhinutErbium(III)oksidimustasta harvinaisesta kultamalmista ja saatuYtterbium(III)oksiditästä oksidista, ja on olemassa toinen kevyemmän alkuaineen oksidi, jonka spektri osoittaa sen olevan tuntematon metalli. Tämä on Mendelejevin ennustama metalli, jonka oksidi onSc₂O₃Itse skandiummetalli valmistettiinSkandiumkloridielektrolyyttisellä sulatuksella vuonna 1937.
Mendelejev
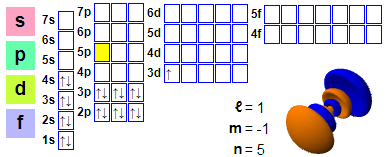
Elektronikonfiguraatio
Elektronikonfiguraatio: 1s2 2s2 2p6 3s2 3p6 4s2 3d1
Skandium on pehmeä, hopeanvalkoinen siirtymämetalli, jonka sulamispiste on 1541 ℃ ja kiehumispiste 2831 ℃.
Skandiumin käyttöä ei pitkään aikaan sen löytämisen jälkeen testattu sen vaikean tuotannon vuoksi. Harvinaisten maametallien erotusmenetelmien kehittyessä on olemassa kypsä prosessi skandiumyhdisteiden puhdistamiseen. Koska skandium on vähemmän emäksinen kuin yttrium ja lantanidi, hydroksidi on heikoin, joten skandiumia sisältävä harvinaisten maametallien sekamineraali erotetaan harvinaisista maametalleista "porrassaostusmenetelmällä", jossa skandium(III)hydroksidia käsitellään ammoniakilla liuokseen siirtämisen jälkeen. Toinen menetelmä on skandiumnitraatin erottaminen nitraatin polaarisella hajottamisella. Koska skandiumnitraatti on helpoin hajottaa, skandium voidaan erottaa. Lisäksi mukana olevan skandiumin kattava talteenotto uraanista, toriumista, volframista, tinasta ja muista mineraaliesiintymistä on myös tärkeä skandiumin lähde.
Kun puhdas skandiumyhdiste on saatu, se muunnetaan ScCl3Å:ksi ja sulatetaan yhdessä KCl:n ja LiCl:n kanssa. Sulaa sinkkiä käytetään katodina elektrolyysissä, jolloin skandium saostuu sinkkielektrodille. Sitten sinkki haihdutetaan, jolloin saadaan metallista skandiumia. Tämä on kevyt hopeanvalkoinen metalli, jolla on erittäin aktiivisia kemiallisia ominaisuuksia ja joka voi reagoida kuuman veden kanssa muodostaen vetykaasua. Kuvassa näkyvä metalliskandium on siis suljettu pulloon ja suojattu argonkaasulla, muuten skandium muodostaa nopeasti tummankeltaisen tai harmaan oksidikerroksen ja menettää kiiltävän metallisen kiiltonsa.
Sovellukset
Valaistusteollisuus
Skandiumin käyttötarkoitukset keskittyvät erittäin kirkkaisiin suuntiin, eikä ole liioittelua kutsua sitä Valon Pojaksi. Skandiumin ensimmäinen taika-ase on nimeltään skandiumnatriumlamppu, jota voidaan käyttää tuomaan valoa tuhansiin kotitalouksiin. Tämä on metallihalogenidilamppu: lamppu on täytetty natriumjodidilla ja skandiumtrijodidilla, ja samanaikaisesti lisätään skandiumia ja natriumfoliota. Korkeajännitteisen purkauksen aikana skandium- ja natriumionit lähettävät vastaavasti valoa ominaisilla emissioaallonpituuksillaan. Natriumin spektriviivat ovat 589,0 ja 589,6 nm, kaksi kuuluisaa keltaista valoa, kun taas skandiumin spektriviivat ovat 361,3–424,7 nm, sarja lähi-ultravioletti- ja sinistä valoemissiota. Koska ne täydentävät toisiaan, tuotettu valon kokonaisväri on valkoinen valo. Juuri siksi, että skandiumnatriumlampuilla on korkea valotehokkuus, hyvä valon väri, energiansäästö, pitkä käyttöikä ja voimakas sumunmuodostuskyky, niitä voidaan käyttää laajalti televisiokameroissa, aukioilla, urheilupaikoilla ja tievalaistuksessa, ja ne tunnetaan kolmannen sukupolven valonlähteinä. Kiinassa tämäntyyppistä lamppua edistetään vähitellen uutena teknologiana, kun taas joissakin kehittyneissä maissa tämäntyyppistä lamppua käytettiin laajalti jo 1980-luvun alussa.
Skandiumin toinen taika-ase on aurinkosähkökennot, jotka voivat kerätä maahan sironneen valon ja muuttaa sen sähköksi ihmisyhteiskunnan pyörittämiseksi. Skandium on paras suojametalli metallieristeissä, puolijohteissa, piiaurinkokennoissa ja aurinkokennoissa.
Sen kolmatta taika-asetta kutsutaan γA-säteilylähteeksi. Tämä taika-ase voi loistaa kirkkaasti itsekseen, mutta tällaista valoa ei voida havaita paljaalla silmällä, vaan se on korkeaenerginen fotonivirta. Yleensä uutamme 45Sc:tä mineraaleista, mikä on skandiumin ainoa luonnollinen isotooppi. Jokainen 45Sc-ydin sisältää 21 protonia ja 24 neutronia. 46Sc, keinotekoinen radioaktiivinen isotooppi, voidaan käyttää γ-säteilylähteenä tai merkkiaineena pahanlaatuisten kasvainten sädehoidossa. On myös sovelluksia, kuten yttrium-galliumskandiumgranaattilaser,Skandiumfluoridilasinen infrapunaoptinen kuitu ja skandiumilla päällystetty katodisädeputki televisiossa. Näyttää siltä, että skandium syntyy kirkkauden mukana.
Seosteollisuus
Skandiumia alkuainemuodossaan on käytetty laajalti alumiiniseosten dopingissa. Kun alumiiniin lisätään muutama tuhannesosa skandiumia, muodostuu uusi Al3Sc-faasi, joka metamorfoituu alumiiniseoksessa ja muuttaa seoksen rakennetta ja ominaisuuksia merkittävästi. 0,2–0,4 % Sc:n lisääminen (joka on käytännössä sama kuin suolan lisääminen kotona paistettuihin vihanneksiin, vain pieni määrä riittää) voi nostaa seoksen uudelleenkiteytymislämpötilaa 150–200 ℃ ja parantaa merkittävästi korkean lämpötilan lujuutta, rakenteellista vakautta, hitsausominaisuuksia ja korroosionkestävyyttä. Se voi myös välttää haurastumisilmiön, jota on helppo esiintyä pitkäaikaisessa työskentelyssä korkeissa lämpötiloissa. Korkean lujuuden ja sitkeyden omaavat alumiiniseokset, uudet korkean lujuuden omaavat, korroosionkestävät, hitsattavat alumiiniseokset, uudet korkean lämpötilan alumiiniseokset, neutronisäteilyä kestävät korkean lujuuden omaavat alumiiniseokset jne. tarjoavat erittäin houkuttelevia kehitysnäkymiä ilmailu- ja avaruusteollisuudessa, ilmailussa, laivoissa, ydinreaktoreissa, kevyissä ajoneuvoissa ja suurnopeusjunissa.
Skandium on myös erinomainen raudan modifioija, ja pieni määrä skandiumia voi parantaa merkittävästi valuraudan lujuutta ja kovuutta. Lisäksi skandiumia voidaan käyttää lisäaineena korkean lämpötilan volframi- ja kromiseoksissa. Tietenkin skandiumilla on korkea sulamispiste ja sen tiheys on samanlainen kuin alumiinilla, ja sitä käytetään myös korkean sulamispisteen kevyissä seoksissa, kuten skandiumtitaaniseoksessa ja skandiummagnesiumseoksessa. Korkean hintansa vuoksi sitä käytetään kuitenkin yleensä vain huippuluokan valmistusteollisuudessa, kuten avaruussukkulissa ja raketeissa.
Keraaminen materiaali
Skandiumia, yksittäistä ainetta, käytetään yleensä seoksissa, ja sen oksideilla on samalla tavalla tärkeä rooli keraamisissa materiaaleissa. Tetragonaalinen zirkoniumoksidikeraaminen materiaali, jota voidaan käyttää elektrodimateriaalina kiinteäoksidipolttokennoissa, on ainutlaatuisella ominaisuudella, jossa tämän elektrolyytin johtavuus kasvaa lämpötilan ja ympäristön happipitoisuuden noustessa. Tämän keraamisen materiaalin kiderakenne itsessään ei kuitenkaan voi olla vakaa, eikä sillä ole teollista arvoa. Sen alkuperäisten ominaisuuksien säilyttämiseksi on tarpeen lisätä joitakin aineita, jotka voivat kiinnittää tämän rakenteen. 6–10 % skandiumoksidin lisääminen on kuin betonirakenne, joten zirkoniumoksidi voidaan stabiloida neliömäiseen hilaan.
On myös teknisiä keraamisia materiaaleja, kuten korkean lujuuden ja korkean lämpötilan kestävää piinitridiä, joita käytetään tiivistiminä ja stabilointiaineina.
TiivistimenäSkandiumoksidivoi muodostaa tulenkestävän faasin Sc2Si2O7 hienojen hiukkasten reunalle, mikä vähentää teknisten keraamien korkean lämpötilan muodonmuutosta. Verrattuna muihin oksideihin se voi parantaa paremmin piinitridin mekaanisia ominaisuuksia korkeissa lämpötiloissa.
Katalyyttinen kemia
Kemiantekniikassa skandiumia käytetään usein katalyyttinä, kun taas Sc2O3:a voidaan käyttää etanolin tai isopropanolin dehydraatioon ja hapetukseen, etikkahapon hajottamiseen ja etyleenin tuotantoon CO:sta ja H2:sta. Sc2O3:a sisältävä PtAl-katalyytti on myös tärkeä katalyytti raskasöljyn hydrauspuhdistus- ja jalostusprosesseissa petrokemian teollisuudessa. Katalyyttisissä krakkausreaktioissa, kuten kumeenissa, Sc-Y-zeoliittikatalyytin aktiivisuus on 1000 kertaa suurempi kuin alumiinisilikaattikatalyytin; verrattuna joihinkin perinteisiin katalyytteihin, skandiumkatalyyttien kehitysnäkymät ovat erittäin valoisat.
Ydinenergiateollisuus
Pienen määrän Sc2O3:n lisääminen UO2:een korkean lämpötilan reaktorin ydinpolttoaineessa voi estää UO2:n muuntumisen U3O8:ksi aiheuttaman hilarakenteen muutoksen, tilavuuden kasvun ja halkeilun.
Polttokenno
Vastaavasti 2,5–25 % skandiumin lisääminen nikkeli-alkaliparistoihin pidentää niiden käyttöikää.
Maatalouden jalostus
Maataloudessa siemeniä, kuten maissia, punajuuria, herneitä, vehnää ja auringonkukka, voidaan käsitellä skandiumsulfaatilla (pitoisuus on yleensä 10-3–10-8 mol/l, eri kasveilla on erilainen vaikutus), ja todellinen itämisen edistävä vaikutus on saavutettu. Kahdeksan tunnin kuluttua juurien ja silmujen kuivapaino kasvoi 37 % ja 78 % taimiin verrattuna, mutta mekanismia tutkitaan vielä.
Nielsenin huomiosta atomimassadatan velkaan tähän päivään asti skandium on ollut ihmisten näköpiirissä vasta sata tai kaksikymmentä vuotta, mutta se on melkein jäänyt penkille sata vuotta. Vasta materiaalitieteen voimakas kehitys viime vuosisadan lopulla toi hänelle elinvoimaa. Nykyään harvinaisista maametalleista, mukaan lukien skandium, on tullut materiaalitieteen kuumia tähtiä, joilla on jatkuvasti muuttuva rooli tuhansissa järjestelmissä, jotka tuovat lisää mukavuutta elämäämme joka päivä ja luovat taloudellista arvoa, jota on entistä vaikeampi mitata.
Julkaisun aika: 29. kesäkuuta 2023