Europium, symboli on Eu ja järjestysluku on 63. Tyypillisenä lantanidiryhmän jäsenenä europiumilla on yleensä +3 valenssi, mutta myös happi +2 valenssi on yleinen. Europiumin yhdisteitä, joiden valenssi on +2, on vähemmän. Verrattuna muihin raskasmetalleihin europiumilla ei ole merkittäviä biologisia vaikutuksia ja se on suhteellisen myrkytön. Useimmissa europiumin sovelluksissa hyödynnetään europiumyhdisteiden fosforesenssivaikutusta. Europium on yksi maailmankaikkeuden vähiten esiintyvistä alkuaineista; niitä on maailmankaikkeudessa vain noin 5 × 10-8 % aineesta on europiumia.
Europiumia esiintyy monasiitissa
Europiumin löytö
Tarina alkaa 1800-luvun lopulla: tuolloin erinomaiset tiedemiehet alkoivat systemaattisesti täyttää Mendelejevin jaksollisen järjestelmän jäljellä olevia aukkoja analysoimalla atomien emissiospektriä. Nykykäsityksen mukaan tämä työ ei ole vaikeaa, ja jopa perustutkinto-opiskelija voi suorittaa sen. Mutta tuolloin tiedemiehillä oli käytössään vain heikon tarkkuuden laitteita ja vaikeasti puhdistettavia näytteitä. Siksi koko lantanidiyhdisteiden löytämisen historiassa kaikki "näennäis"löytäjät esittivät jatkuvasti vääriä väitteitä ja väittelivät keskenään.
Vuonna 1885 Sir William Crookes löysi ensimmäisen, mutta ei kovin selkeän, alkuaineen 63 signaalin: hän havaitsi tietyn punaisen spektriviivan (609 nm) samariumnäytteessä. Vuosien 1892 ja 1893 välillä galliumin, samariumin ja dysprosiumin löytäjä Paul é mile LeCoq de Boisbaudran vahvisti tämän kaistan ja löysi toisen vihreän kaistan (535 nm).
Seuraavaksi, vuonna 1896, Eugè ne Anatole Demarç erotti kärsivällisesti samariumoksidia ja vahvisti uuden harvinaisen maametallin löytymisen samariumin ja gadoliniumin väliltä. Hän erotti tämän alkuaineen onnistuneesti vuonna 1901, mikä merkitsi löytömatkansa loppua: "Toivon voivani nimetä tämän uuden alkuaineen europiumiksi, symbolilla Eu ja atomimassalla noin 151."
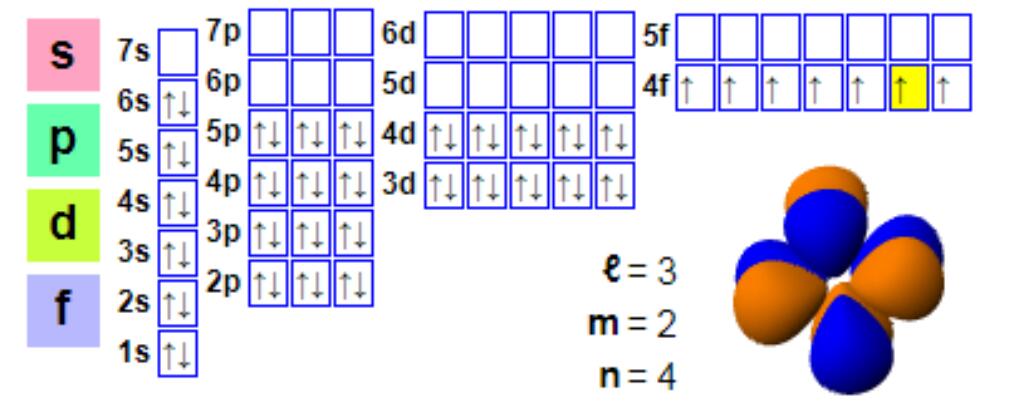
Elektronikonfiguraatio
Elektronikonfiguraatio:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f7
Vaikka europium on yleensä kolmiarvoinen, se muodostaa helposti kaksiarvoisia yhdisteitä. Tämä ilmiö eroaa useimpien lantanidi-indiaanien +3-valenssisten yhdisteiden muodostumisesta. Kaksiarvoisella europiumilla on elektroninen konfiguraatio 4f7, koska puolitäytetty f-kuori tarjoaa enemmän stabiiliutta, ja europium(II) ja barium(II) ovat samankaltaisia. Kaksiarvoinen europium on lievä pelkistin, joka hapettuu ilmassa muodostaen europium(III)-yhdisteen. Anaerobisissa olosuhteissa, erityisesti lämmitysolosuhteissa, kaksiarvoinen europium on riittävän stabiili ja pyrkii liittymään kalsiumiin ja muihin maa-alkalimineraaleihin. Tämä ioninvaihtoprosessi on "negatiivisen europiumanomalisuuden" perusta, eli verrattuna kondriitin runsauteen monilla lantanidimineraaleilla, kuten monasiitilla, on alhainen europiumpitoisuus. Monasiittiin verrattuna bastnasiitilla on usein vähemmän negatiivisia europiumanomalioita, joten bastnasiitti on myös europiumin tärkein lähde.
Europium on raudanharmaa metalli, jonka sulamispiste on 822 °C, kiehumispiste 1597 °C ja tiheys 5,2434 g/cm³. Se on harvinaisten maametallien joukossa vähiten tiheä, pehmein ja haihtuvin alkuaine. Europium on harvinaisten maametallien joukossa aktiivisin metalli: huoneenlämmössä se menettää välittömästi metallisen kiiltonsa ilmassa ja hapettuu nopeasti jauheeksi; Reagoi voimakkaasti kylmän veden kanssa muodostaen vetykaasua; Europium voi reagoida boorin, hiilen, rikin, fosforin, vedyn, typen jne. kanssa.
Europiumin käyttö
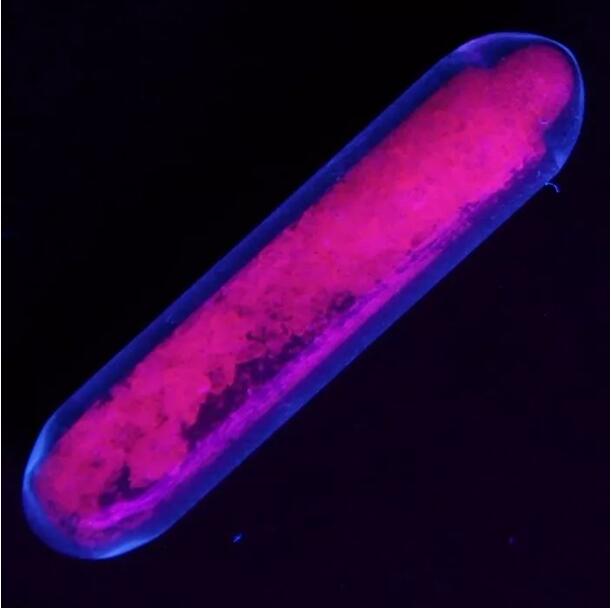
Europiumsulfaatti emittoi punaista fluoresenssia ultraviolettivalossa
Nuori merkittävä kemisti Georges Urbain peri Demar ç Ayn spektroskopialaitteen ja havaitsi vuonna 1906, että europiumilla seostettu yttrium(III)oksidinäyte lähetti erittäin kirkasta punaista valoa. Tämä on europiumia fosforoivien materiaalien pitkän matkan alku – niitä käytetään paitsi punaisen myös sinisen valon lähettämiseen, koska Eu2+:n emissiospektri on tälle alueelle.
Punaisesta Eu3+-, vihreästä Tb3+- ja sinisestä Eu2+-emitteristä tai niiden yhdistelmästä koostuva fosfori voi muuntaa ultraviolettivalon näkyväksi valoksi. Näillä materiaaleilla on tärkeä rooli useissa eri laitteissa ympäri maailmaa: röntgensäteilyä vahvistavissa näytöissä, katodisädeputkissa tai plasmanäytöissä sekä uusissa energiansäästölampuissa ja valodiodeissa.
Kolmiarvoisen europiumin fluoresenssivaikutus voidaan myös herkistää orgaanisilla aromaattisilla molekyyleillä, ja tällaisia komplekseja voidaan soveltaa erilaisissa tilanteissa, jotka vaativat suurta herkkyyttä, kuten väärentämisenestomusteissa ja viivakoodeissa.
1980-luvulta lähtien europiumilla on ollut johtava rooli erittäin herkässä biolääketieteellisessä analyysissä, jossa käytetään aikaerotteista kylmäfluoresenssimenetelmää. Useimmissa sairaaloissa ja lääketieteellisissä laboratorioissa tällaisesta analyysistä on tullut rutiinia. Biotieteiden tutkimuksessa, mukaan lukien biologinen kuvantaminen, europiumista ja muista lantanideista valmistetut fluoresoivat biologiset anturit ovat kaikkialla. Onneksi yksi kilogramma europiumia riittää noin miljardin analyysin tukemiseen – Kiinan hallituksen äskettäin rajoitettua harvinaisten maametallien vientiä, harvinaisten maametallien varastointipulasta paniikissa olevien teollisuusmaiden ei tarvitse huolehtia vastaavista uhkista tällaisissa sovelluksissa.
Europiumoksidia käytetään stimuloidun emission fosforina uusissa röntgenlääketieteellisissä diagnostiikkajärjestelmissä. Europiumoksidia voidaan käyttää myös värillisten linssien ja optoelektronisten suodattimien valmistukseen, magneettikuplavarastolaitteissa sekä ohjausmateriaaleissa, suojamateriaaleissa ja atomireaktorien rakennemateriaaleissa. Koska sen atomit voivat absorboida enemmän neutroneja kuin mikään muu alkuaine, sitä käytetään yleisesti neutroneja absorboivana materiaalina atomireaktoreissa.
Nykymaailmassa, joka kasvaa nopeasti, äskettäin löydetyllä europiumin sovelluksella voi olla syvällisiä vaikutuksia maatalouteen. Tutkijat ovat havainneet, että kaksiarvoisella europiumilla ja yksiarvoisella kuparilla seostetut muovit voivat tehokkaasti muuntaa auringonvalon ultraviolettisäteilyn näkyväksi valoksi. Tämä prosessi on varsin vihreä (se on punaisen vastaväri). Tämän tyyppisen muovin käyttö kasvihuoneen rakentamisessa voi auttaa kasveja absorboimaan enemmän näkyvää valoa ja lisätä satoa noin 10 %.
Europiumia voidaan käyttää myös kvanttimuistisiruissa, jotka voivat tallentaa tietoa luotettavasti useiden päivien ajan. Näiden avulla arkaluontoista kvanttidataa voidaan tallentaa kiintolevyn kaltaiseen laitteeseen ja toimittaa maan halki.
Julkaisun aika: 27. kesäkuuta 2023